MENÜ
CH | CHF
CH | CHF
-
- Tischzentrifugen
- Standzentrifugen
- Gekühlte Zentrifugen
- Mikrozentrifugen
- Mehrzweckzentrifugen
- Hochgeschwindigkeitszentrifugen
- Ultrazentrifugen
- Concentrator
- IVD Produkte
- High-Speed and Ultracentrifuge Consumables
- Zentrifugenröhrchen
- Zentrifugenplatten
- Gerätemanagement
- Proben- und Informationsmanagement
-
- Manuelles Pipettieren & Dispensieren
- Mechanische Pipetten
- Elektronische Pipetten
- Mehrkanalpipetten
- Direktverdrängerpipetten & Dispenser
- Automatisches Pipettieren
- Flaschenaufsatzdispenser
- Pipettierhilfen
- Pipettenspitzen
- Verbrauchsartikel für die Automation
- Zubehör für Dispenser & Pipetten
- Zubehör für die Automation
- Services für Dispenser & Pipetten
Es konnten keine Ergebnisse gefunden werden.
Such-Empfehlungen

Eine niedrige Sauerstoffkonzentration unterstützt die xenofreie Entwicklung, Expansion und Differenzierung von humanen iPS-Zellen
RICK COHEN
Wir konnten in vorangegangenen Arbeiten zeigen, dass die Verwendung einer niedrigen Sauerstoffkonzentration die Effizienz einer Reprogrammierung humaner somatischer Zellen zur Pluripotenz steigert [1].
Die Ergebnisse der vorliegenden Arbeit ermöglichen eine Weiterentwicklung dieses Kultivierungs-Paradigmas. Wir konnten beobachten, dass Fibroblasten nach der Elektroporation bei 4 % O2-Gehalt auf synthetischen sowie biologischen Oberflächen wachsen. Weiterhin beobachteten wir eine normale Ausbreitung von iPS-Zellkolonien mit einem hohen Reinheitsgrad in frühen Passagen. Die Zellen wurden erfolgreich in Motoneuronen sowie Kardiomyozyten-Lineages differenziert, was die Wirksamkeit des niedrigen Sauerstoffgehalts während der Zellkultivierung unterstreicht.
Die Ergebnisse der vorliegenden Arbeit ermöglichen eine Weiterentwicklung dieses Kultivierungs-Paradigmas. Wir konnten beobachten, dass Fibroblasten nach der Elektroporation bei 4 % O2-Gehalt auf synthetischen sowie biologischen Oberflächen wachsen. Weiterhin beobachteten wir eine normale Ausbreitung von iPS-Zellkolonien mit einem hohen Reinheitsgrad in frühen Passagen. Die Zellen wurden erfolgreich in Motoneuronen sowie Kardiomyozyten-Lineages differenziert, was die Wirksamkeit des niedrigen Sauerstoffgehalts während der Zellkultivierung unterstreicht.
Mehr erfahren
Weniger lesen
EInleitung
Die Reprogrammierung humaner somatischer Zellen in das pluripotente Stadium ist das Thema zahlreicher Publikationen seit ihrer Entdeckung im Jahr 2007. Die ersten Studien wurden mit einem Set von vier Genen durchgeführt, welche in nativen humanen embryonalen Stammzellen exprimiert werden: Oct4, Sox2, KLF4 und c-Myc (Lin28 und Nanog). Diese Gene wurden mit Hilfe genetisch modifizierender Methoden, wie z.B. retrovirale Vektoren, in die Zellen eingeführt, gefolgt von Kultivierung auf undefinierten Wachstumssubstraten. In den 13 Jahren, die seit diesen zukunftsweisenden Studien vergangen sind, wurden zahlreiche Verbesserungen erzielt, wie z.B. (1) der Ersatz genetisch modifizierender Methoden durch sicherere, das Genom nicht verändernde Alternativen; (2) Substitution des c-Myc Oncogens durch das nicht transformierende Familienmitglied L-Myc; (3) der Einsatz niedermolekularer Verbindungen zur Effizienzsteigerung der Reprogrammierung; (4) Optimierung der Zellkulturbedingungen, einschließlich niedriger O2-Konzentration (4–5 %) und (5) der Einsatz klinisch relevanter, definierter Medien und Wachstumssubstrate.
In dieser neuen Studie kombinierten wir zahlreiche dieser Verbesserungen, um die erfolgreiche Reprogrammierung von humanen Fibroblasten mit Hilfe niedriger O2-Konzentration im CellXpert® C170i CO2-Inkubator aufzuzeigen. Wir beobachteten, dass die untersuchten Wachstumssubstrate der reprogrammierten Fibroblasten eine stabile Zelladhäsion sowie -ausbreitung gewährleisteten. Dies führte wiederum zu einer robusten Produktion karyotypisch normaler iPSC-Kolonien mit der Fähigkeit, in einem definierten Medium robust zu expandieren sowie zu neuronalen und kardialen Lineages differenziert zu werden.
Material und Methoden
Die Reagenzien und Verfahren in dieser Application Note* entsprechen den bereits beschriebenen Methoden. Wenn angezeigt, wurden Kulturgefäße mit 5 μg/mL Vitronectin beschichtet und als Vergleich zu einem synthetischen Substrat eingesetzt. Sobald es zur Entwicklung von iPSC-Kolonien im Reprogrammierungsmedium kam, wurden diese zur weiteren Expansion in „Animal Free Low Protein hESC“-Medium überführt. iPSC-Expansion und die frühen Schritte der neuronalen Differenzierung wurden in 6-Well-Platten durchgeführt, während Zellen, welche mit Hilfe von Immunanfärbung analysiert oder endgültig zu Motoneuronen oder Kardiomyozyten differenziert wurden, in 24-Well- Kulturplatten ausgesät wurden. Die Entwicklung von Neuronen wurde wie zuvor beschrieben durchgeführt.
Ergebnisse und Diskussion
Expansion und Charakterisierung von iPSC unter hypoxischen Bedingungen
Am 21. bis 30. Tag nach ihrer Modifikation entwickelten sich aus den rudimentären iPSC-Kolonien ausgereiftere Kolonien. Diese wurden mit Hilfe von schonenden nicht-enzymatischen Methoden passagiert. Reine iPSC-Kolonien wurden von Hand selektiert. Auf synthetischen Substraten gewachsene iPSC hingegen überwuchsen innerhalb kürzester Zeit die geringe Anzahl von Fibroblasten, die durch die nicht-enzymatische Passagierung abgelöst worden waren.
Nach sieben Passagen wurde die durch episomale Plasmide neu programmierte Linie auf der synthetischen Beschichtung karyotypisch analysiert und für normal befunden. Ähnliche Kulturen wurden auf 24-Well-Platten ausgesät und in Bezug auf Pluripotenz oder Expression von Differenzierungsmarkern analysiert (Abb. 1).
Nach acht Passagen fehlte den Kulturen jegliche messbare Expression von SSEA1, bei robuster Expression von sowohl SSEA4 als auch Oct4. Ebenso exprimierten diese Zellen gleichzeitig Lin28, Nanog und Tra-1-60.
Die Reprogrammierung humaner somatischer Zellen in das pluripotente Stadium ist das Thema zahlreicher Publikationen seit ihrer Entdeckung im Jahr 2007. Die ersten Studien wurden mit einem Set von vier Genen durchgeführt, welche in nativen humanen embryonalen Stammzellen exprimiert werden: Oct4, Sox2, KLF4 und c-Myc (Lin28 und Nanog). Diese Gene wurden mit Hilfe genetisch modifizierender Methoden, wie z.B. retrovirale Vektoren, in die Zellen eingeführt, gefolgt von Kultivierung auf undefinierten Wachstumssubstraten. In den 13 Jahren, die seit diesen zukunftsweisenden Studien vergangen sind, wurden zahlreiche Verbesserungen erzielt, wie z.B. (1) der Ersatz genetisch modifizierender Methoden durch sicherere, das Genom nicht verändernde Alternativen; (2) Substitution des c-Myc Oncogens durch das nicht transformierende Familienmitglied L-Myc; (3) der Einsatz niedermolekularer Verbindungen zur Effizienzsteigerung der Reprogrammierung; (4) Optimierung der Zellkulturbedingungen, einschließlich niedriger O2-Konzentration (4–5 %) und (5) der Einsatz klinisch relevanter, definierter Medien und Wachstumssubstrate.
In dieser neuen Studie kombinierten wir zahlreiche dieser Verbesserungen, um die erfolgreiche Reprogrammierung von humanen Fibroblasten mit Hilfe niedriger O2-Konzentration im CellXpert® C170i CO2-Inkubator aufzuzeigen. Wir beobachteten, dass die untersuchten Wachstumssubstrate der reprogrammierten Fibroblasten eine stabile Zelladhäsion sowie -ausbreitung gewährleisteten. Dies führte wiederum zu einer robusten Produktion karyotypisch normaler iPSC-Kolonien mit der Fähigkeit, in einem definierten Medium robust zu expandieren sowie zu neuronalen und kardialen Lineages differenziert zu werden.
Material und Methoden
Die Reagenzien und Verfahren in dieser Application Note* entsprechen den bereits beschriebenen Methoden. Wenn angezeigt, wurden Kulturgefäße mit 5 μg/mL Vitronectin beschichtet und als Vergleich zu einem synthetischen Substrat eingesetzt. Sobald es zur Entwicklung von iPSC-Kolonien im Reprogrammierungsmedium kam, wurden diese zur weiteren Expansion in „Animal Free Low Protein hESC“-Medium überführt. iPSC-Expansion und die frühen Schritte der neuronalen Differenzierung wurden in 6-Well-Platten durchgeführt, während Zellen, welche mit Hilfe von Immunanfärbung analysiert oder endgültig zu Motoneuronen oder Kardiomyozyten differenziert wurden, in 24-Well- Kulturplatten ausgesät wurden. Die Entwicklung von Neuronen wurde wie zuvor beschrieben durchgeführt.
Ergebnisse und Diskussion
Expansion und Charakterisierung von iPSC unter hypoxischen Bedingungen
Am 21. bis 30. Tag nach ihrer Modifikation entwickelten sich aus den rudimentären iPSC-Kolonien ausgereiftere Kolonien. Diese wurden mit Hilfe von schonenden nicht-enzymatischen Methoden passagiert. Reine iPSC-Kolonien wurden von Hand selektiert. Auf synthetischen Substraten gewachsene iPSC hingegen überwuchsen innerhalb kürzester Zeit die geringe Anzahl von Fibroblasten, die durch die nicht-enzymatische Passagierung abgelöst worden waren.
Nach sieben Passagen wurde die durch episomale Plasmide neu programmierte Linie auf der synthetischen Beschichtung karyotypisch analysiert und für normal befunden. Ähnliche Kulturen wurden auf 24-Well-Platten ausgesät und in Bezug auf Pluripotenz oder Expression von Differenzierungsmarkern analysiert (Abb. 1).
Nach acht Passagen fehlte den Kulturen jegliche messbare Expression von SSEA1, bei robuster Expression von sowohl SSEA4 als auch Oct4. Ebenso exprimierten diese Zellen gleichzeitig Lin28, Nanog und Tra-1-60.
Mehr erfahren
Weniger lesen
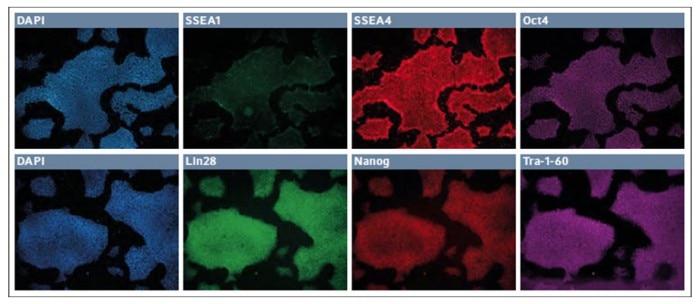
Abb. 1: Immunfluoreszenz-Anfärbung der Pluripotenz- bzw. Differenzierungs-Marker in iPSC niedriger Passagen
Differenzierung von iPSC in neuronale bzw. Herzmuskel-Zellen
Die iPSC wurden zunächst zu Neuroepithelzellen differenziert und daraufhin in neuronale Stammzellen. Nach vier Passagen in neuronalem Stammzellmedium schienen sich die Zellen in eine einheitliche Schicht zu differenzieren, mit einem sich wiederholenden, für neuronale Stammzellen charakteristischen Rosettenmuster. Viele dieser Zellen waren OTX2-positiv, wobei eine größere Anzahl von Zellen sowohl Pax6 als auch Nestin exprimierte. Da dies den zweiten von vier Schritten zu abgeleiteten Motoneuronen darstellte, fuhren wir fort, die Stammzellen in Vorläufer von Motoneuronen zu differenzieren.
Die niedermolekularen Verbindungen und Wachstumsfaktoren wurden verändert, um mit dem Differenzierungsprotokoll fortzufahren (Abb. 2, obere Bildreihe); einige Zellen exprimierten weiterhin OTX2 und Nestin, während viele Zellen begannen, Olig2 zu exprimieren – einen motoneuronalen Marker.
Nach einer Woche wurden die Zellen einer Reihe von Zytokinen und niedermolekularen Verbindungen ausgesetzt, um die endgültige Differenzierung zu Motoneuronen zu induzieren (Abb. 2, untere Bildreihe).
Die iPSC wurden zunächst zu Neuroepithelzellen differenziert und daraufhin in neuronale Stammzellen. Nach vier Passagen in neuronalem Stammzellmedium schienen sich die Zellen in eine einheitliche Schicht zu differenzieren, mit einem sich wiederholenden, für neuronale Stammzellen charakteristischen Rosettenmuster. Viele dieser Zellen waren OTX2-positiv, wobei eine größere Anzahl von Zellen sowohl Pax6 als auch Nestin exprimierte. Da dies den zweiten von vier Schritten zu abgeleiteten Motoneuronen darstellte, fuhren wir fort, die Stammzellen in Vorläufer von Motoneuronen zu differenzieren.
Die niedermolekularen Verbindungen und Wachstumsfaktoren wurden verändert, um mit dem Differenzierungsprotokoll fortzufahren (Abb. 2, obere Bildreihe); einige Zellen exprimierten weiterhin OTX2 und Nestin, während viele Zellen begannen, Olig2 zu exprimieren – einen motoneuronalen Marker.
Nach einer Woche wurden die Zellen einer Reihe von Zytokinen und niedermolekularen Verbindungen ausgesetzt, um die endgültige Differenzierung zu Motoneuronen zu induzieren (Abb. 2, untere Bildreihe).
Mehr erfahren
Weniger lesen
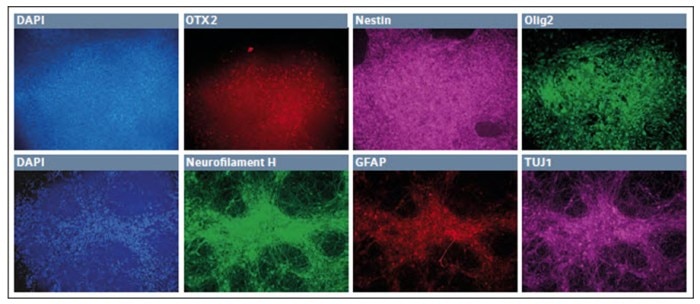
Abb. 2: Differenzierung von iPSC in Motoneuronen-Vorläuferzellen in einer Umgebung mit niedrigem Sauerstoffgehalt
Nach sieben Tagen im abschließenden Medium-Cocktail organisierten die Zellen ein feines, robustes Neurofilament H-positives Netzwerk, mit einem geringen Rest eines TUJ1+ Erscheinungsbildes und wenigen GFAP+ Gliazellen. Insgesamt zeigten diese Ergebnisse, dass hypoxische Kultivierung eingesetzt werden kann, um Zellen der neuro-ektodermalen Abstammungslinie zu erzeugen. Zusätzlich waren wir in der Lage, die Zellen zunächst in endgültiges Endoderm zu differenzieren, gefolgt von der Entwicklung zu Kardiomyozyten (Abb. 3).
Mehr erfahren
Weniger lesen
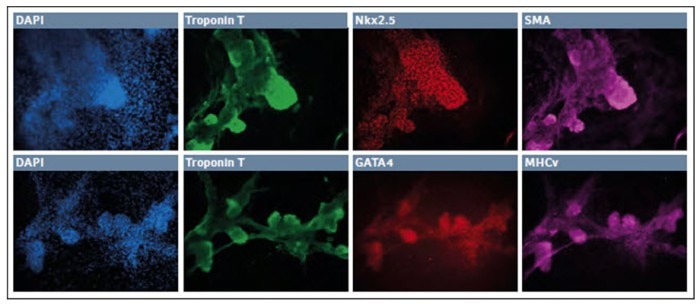
Abb. 3: Differenzierung von iPSC zu Kardiomyozyten in einer niedrigen O2-Umgebung
Nach 10–11 Tagen in Kultur organisierten sich die überlebenden Zellen in kleine Kolonien. Diese „Knotenpunkte“ waren hochgradig dreidimensional und exprimierten Troponin T, Nkx2.5 und SMA.
Wir beobachteten eine zusätzliche robuste Expression von Troponin T, gemeinsam mit GATA4 und MHCv. Gemeinsam kennzeichnen diese Ergebnisse eine erfolgreiche Entwicklung der Kardiomyozyten-Abstammungslinie in einer hypoxischen Umgebung.
Fazit
Wir zeigten eine erfolgreiche Reprogrammierung von humanen Fibroblasten in hypoxischer Umgebung im CellXpert C170i CO2-Inkubator. Die iPSC-Linie wurde als karyotypisch normal charakterisiert und exprimierte die erwarteten Marker für Pluripotenz. Weiterhin unterstützte die niedrige O2-Umgebung die zuverlässige Differenzierung der iPSC in verschiedene Stadien von Ektoderm, neuronalen Stammzellen, Vorläufern von Motoneuronen sowie letztendlich Motoneuronen. Ebenfalls unterstützt die hypoxische Atmosphäre innerhalb des Inkubators die Differenzierung derselben iPSC-Linie in Kardiomyozyten.
*Download der vollständigen Application Note 443
Literatur
[1] Low Oxygen Levels Enhance the Efficiency of Reprogramming Human Somatic Cells to Pluripotency. Eppendorf Application Note 338 .
Hinweis: Die Eppendorf SE behält sich das Recht vor, ihre Produkte und Dienstleistungen jederzeit zu ändern. Diese Application Note kann ohne Vorankündigung geändert werden. Wenngleich größte Sorgfalt darauf verwendet wurde, die Richtigkeit und Vollständigkeit dieser Informationen zu gewährleisten, übernimmt die Eppendorf SE keine Haftung für eventuelle Fehler oder Schäden, die sich aus der Anwendung oder dem Gebrauch dieser Informationen ergeben. Die Heranziehung von Application Notes allein kann das Lesen und Einhalten der jeweils aktuellen Version der Bedienungsanleitung nicht ersetzen.
Wir beobachteten eine zusätzliche robuste Expression von Troponin T, gemeinsam mit GATA4 und MHCv. Gemeinsam kennzeichnen diese Ergebnisse eine erfolgreiche Entwicklung der Kardiomyozyten-Abstammungslinie in einer hypoxischen Umgebung.
Fazit
Wir zeigten eine erfolgreiche Reprogrammierung von humanen Fibroblasten in hypoxischer Umgebung im CellXpert C170i CO2-Inkubator. Die iPSC-Linie wurde als karyotypisch normal charakterisiert und exprimierte die erwarteten Marker für Pluripotenz. Weiterhin unterstützte die niedrige O2-Umgebung die zuverlässige Differenzierung der iPSC in verschiedene Stadien von Ektoderm, neuronalen Stammzellen, Vorläufern von Motoneuronen sowie letztendlich Motoneuronen. Ebenfalls unterstützt die hypoxische Atmosphäre innerhalb des Inkubators die Differenzierung derselben iPSC-Linie in Kardiomyozyten.
*Download der vollständigen Application Note 443
Literatur
[1] Low Oxygen Levels Enhance the Efficiency of Reprogramming Human Somatic Cells to Pluripotency. Eppendorf Application Note 338 .
Hinweis: Die Eppendorf SE behält sich das Recht vor, ihre Produkte und Dienstleistungen jederzeit zu ändern. Diese Application Note kann ohne Vorankündigung geändert werden. Wenngleich größte Sorgfalt darauf verwendet wurde, die Richtigkeit und Vollständigkeit dieser Informationen zu gewährleisten, übernimmt die Eppendorf SE keine Haftung für eventuelle Fehler oder Schäden, die sich aus der Anwendung oder dem Gebrauch dieser Informationen ergeben. Die Heranziehung von Application Notes allein kann das Lesen und Einhalten der jeweils aktuellen Version der Bedienungsanleitung nicht ersetzen.
Mehr erfahren
Weniger lesen
Verwandte Dokumente
Mehr erfahren
Weniger lesen
