
Herstellung rekombinanter humaner Phosphoserinphosphatase mit dem Innova® S44i-Schüttler und dem Zentrifugen Harvesting Bundle 4 x 1.5 L
NATASCHA WEISS, VINCENT DUFEY, SILVIA TEJERINA VARGAS, AURÉLIE TACHENY Lab Academy
- Biotechnology
- Vessels
- Mixers & Shakers
- Centrifugation
- BioNews article
Die Herstellung rekombinanter Proteine durch gentechnisch veränderte Organismen ist eine grundlegende biotechnologische Technik. Ziel ist es, eine hohe Ausbeute an funktionalem Protein zu erzielen, wozu Zellen in großem Maßstab – bei gutem Zellwachstum und hervorragender Proteinexpression – kultiviert werden müssen. Dafür wird ein robuster Schüttler benötigt, in dem Kulturen mit hoher Umdrehungszahl im Litermaßstab geschüttelt werden können. Zur Zellernte, zur Klärung des Zelllysats und (falls erforderlich) zur Konzentration der Proteinlösung wird die Zentrifugation eingesetzt.
In dieser Application Note werden die Produktion eines rekombinanten Proteins anhand eines Arbeitsablaufs für die Kultivierung und Ernte von Bakterien sowie die Aufreinigung der Proteine dargestellt. Dabei soll demonstriert werden, dass eine hohe Ausbeute an funktionellem Protein durch den Einsatz des Innova S44i und einer Hochgeschwindigkeitszentrifuge (als Systemlösung mit Harvesting Bundle und High-Speed Pelleting Kit) erzielt werden kann.
Material und Methoden
Material
Expressionssystem: E. coli BL21 (DE3) transformiert mit dem Plasmid pET28a (mit dem Gen, was für das His-Tag Protein der humanen Phosphoserinphosphatase [hPSP] kodiert).
Kultursystem: Inkubationsschüttler Innova S44i.
Zentrifugationssystem: Harvesting Bundle (Centrifuge CR30NX inkl. 6-L-Rotor R9A2 und 4 x 1,5-L-Dreiecksflaschen) und High-Speed Pelleting Kit (Rotor R19A2 mit konischen 50-mL-Gefäßen). Alternativ kann auch die Zentrifuge CR22N verwendet werden.
Methoden
Bakterienvermehrung und Induktion: Zu 50 mL Medium in einer 250-mL-Flasche wurden 50 µL E. coli (mit pET28a) in Glycerin hinzugefügt. Die Kultur wurde über Nacht im Innova S44i (300 rpm, 37 °C) bis zu einer OD600 von 15 – 25 inkubiert. Jeweils 5 mL der Starterkultur wurden in drei 2,5-L-Flaschen gegeben, die mit 1 L Medium befüllt waren. Sie wurden im S44i (250 rpm, 37 °C) bis zu einer OD600 von ca. 2 (~4 – 5 h) inkubiert. Nach Zugabe von 10 mL IPTG wurde die Inkubation für 3 h fortgesetzt. Anschließend wurde die Suspension in zwei 1,5-L-Dreiecksflaschen überführt und in der Centrifuge CR30NX mit dem Rotor R9A2 (4.000 rpm, 30 min, 4 °C) zentrifugiert. Der Überstand wurde verworfen.
Lyse: Pro Gramm Bakterienpellet wurden 20 mL Lysepuffer zugegeben und resuspendiert. Nach 30 min Rühren wurde die Suspension mit Ultraschall behandelt. Das Lysat wurde in 50-mL-konischen Gefäßen durch Zentrifugation (Rotor R19A2, 12.500 rpm, 1 h, 4 °C) geklärt. Der Überstand wurde entnommen und durch einen 0,2-µm-Filter filtriert.
Aufreinigung durch Affinitätschromatographie: Das geklärte Lysat (400 mL) wurde auf eine gewaschene und äquilibrierte HisTrap™ FF-Säule aufgetragen. Nach dem Waschen wurde Elutionspuffer mit 20 % Imidazol verwendet, um die ersten 10 Fraktionen zu gewinnen. Weitere 10 Fraktionen wurden unter Verwendung von Elutionspuffer mit 100 % Imidazol erhalten.
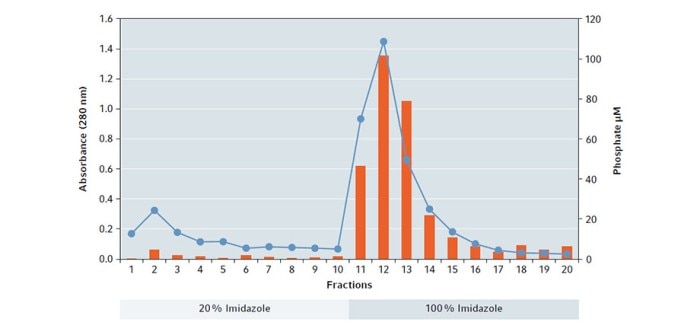
Analyse: Die Menge an Gesamtprotein wurde für alle Proteinfraktionen über die Absorption bei 280 nm bestimmt. Proben wurden mittels SDS-PAGE aufgetrennt und mit Coomassie® -Blau angefärbt. Zusätzlich wurde die Enzymaktivität mit einem Malachitgrün-Phosphat-Assay gemessen.
Ergebnisse und Diskussion
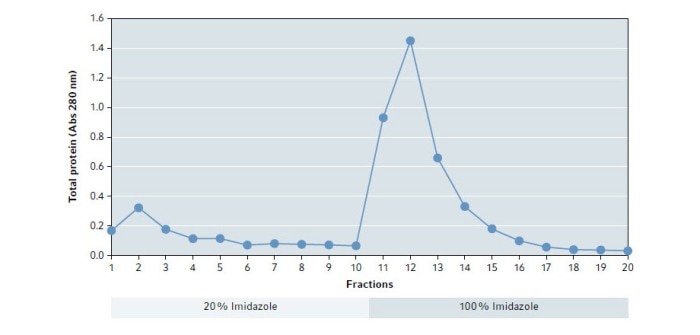
Zur Entfernung von Verunreinigungen wurde der Elutionspuffer mit 20 % Imidazol eingesetzt. Die Elution mit 100 % Imidazol Puffer wurde verwendet, um das gereinigte Protein zu gewinnen. Die relevanten Fraktionen wurden über eine Absorptionsmessung bei 280 nm bestimmt.
Die Ergebnisse der Absorptionsmessung zeigen, dass durch den Puffer mit 100 % Imidazol ein großer Anteil an Proteinen gelöst wird mit dem höchsten Anteil in Fraktion 12 (Abb. 1).
Mehr erfahren
Weniger lesen
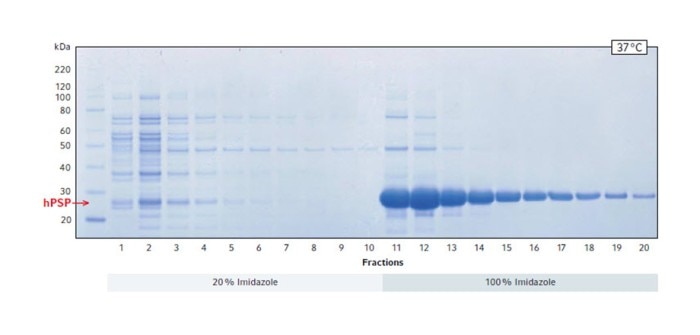
Das mit Coomassie-Blau gefärbte SDS-Gel bestätigt, dass eine große Menge Protein ab Fraktion 11 herausgelöst wurde (Abb. 2). Die Position der größten Bande weist darauf hin, dass es sich um das Zielprotein hPSP handelt, welches eine Größe von 25 kDa aufweist.
Mehr erfahren
Weniger lesen
Mehr erfahren
Weniger lesen
Der S44i ermöglicht durch sein robustes Design und seine hohe Gefäßkapazität die Kultivierung von Mikroorganismen bei hohen Geschwindigkeiten und schwerer Beladung [2]. Das Harvesting Bundle der Hochgeschwindigkeitszentrifuge, bestehend aus dem 4 x 1,5 L Rotor und den dazugehörigen 1,5-L-Dreiecksflaschen, stellt ein abgestimmtes System für die Ernte von Zellen dar. Das innovative Format der Flaschen vereinfacht die Handhabung, und die Verarbeitung von 1,5 L Kulturvolumen pro Flasche spart bei jedem Arbeitsschritt Zeit (bis zu 32 % der Prozesszeit im Vergleich zur Bearbeitung von 6 Flaschen mit je 1 L Volumen [1]). Zusätzlich wird nur noch der High-Speed Pelleting Kit für konische Gefäße benötigt, um alle Zentrifugationsschritte für die Herstellung eines rekombinanten Proteins von der Ernte bis zur Konzentration abzudecken.
*Download der kompletten Application Note 451
Literatur
[1] Tacheny A. Unique 4 x 1.5 L Capacity Rotor for High-Speed Centrifuges CR22N and CR30NX. Eppendorf White Paper No. 64
[2] Hartmann I., Jarvis J. The New Eppendorf X-Drive – Maximum Performance, Flexibility and Longevity for Demanding Shaker Tasks. Eppendorf White Paper No. 47
Hinweis: Die Eppendorf SE behält sich das Recht vor, ihre Produkte und Dienstleistungen jederzeit zu ändern. Diese Application Note kann ohne Vorankündigung geändert werden. Wenngleich größte Sorgfalt darauf verwendet wurde, die Richtigkeit und Vollständigkeit dieser Informationen zu gewährleisten, übernimmt die Eppendorf SE keine Haftung für eventuelle Fehler oder Schäden, die sich aus der Anwendung oder dem Gebrauch dieser Informationen ergeben. Die Heranziehung von Application Notes allein kann das Lesen und Einhalten der jeweils aktuellen Version der Bedienungsanleitung nicht ersetzen.
Mehr erfahren
Weniger lesen
Weiterführende Links
Mehr erfahren
Weniger lesen
Verwandte Dokumente
Mehr erfahren
Weniger lesen
